引言
HR-DDR(同源重组、DNA 损伤反应及修复)通路中多个关键组分的遗传改变,已被证实与遗传性癌症综合征密切相关。除了BRCA1/2、ATM和PALB2等常见的致病基因外,其他HR-DDR通路基因的突变也可能导致胰腺导管腺癌(PDAC)出现HR-DDR缺陷。
研究团队聚焦于包含15个基因的HR-DDR检测Panel,利用全外显子测序(WES)和全基因组测序(WGS)技术,深入鉴定并表征了PDAC样本中的遗传变异。在生信分析环节,团队采用Sentieon Haplotyper算法精准检测SNP和INDEL。
研究结果显示,不同HR-DDR基因的突变状态与同源重组缺陷(HRD)评分的高低存在显著关联。在50例PDAC患者中,研究团队鉴定出8例肿瘤携带至少一个HR-DDR基因突变。其中,携带BRCA2突变的肿瘤表现出较高的HRD评分,而携带CHEK2突变的肿瘤 HRD评分则为零。值得关注的是,本研究中有4例PDAC患者携带RAD51B基因突变,且均为胚系突变。但目前的胚系基因检测Panel尚未涵盖RAD51B。
本周Sentieon文献解读专栏为大家推荐一篇发表于2022年JCO Precision Oncology 的佳作——《RAD51B Harbors Germline Mutations Associated With Pancreatic Ductal Adenocarcinoma》。该研究由深圳华大基因(BGI)与美国约翰·霍普金斯大学(JHU)等机构合作完成。
我们特此对该文进行解读,希望能为从事肿瘤遗传学及精准医学研究的同仁提供有价值的参考。
材料与方法学
研究对象与基因Panel
HR-DDR基因Panel:研究针对HR-DDR通路的伴随诊断15基因Panel展开分析,具体包括:BRCA1、BRCA2、ATM、BARD1、BRIP1、CDK12、CHEK1、CHEK2、FANCL、PALB2、PPP2R2A、RAD51B、RAD51C、RAD51D 和 RAD54L。
患者队列:研究人员从胰腺癌精准医学卓越中心登记数据库中,纳入了50例连续入组的 PDAC患者。这些患者均在2016年3月至2018年2月期间接受治疗。
研究方法
DNA提取、文库制备和测序
研究团队提取基因组DNA后,针对DNA足量的样本,同时构建了WES和WGS文库。所有文库均在DIPSEQ平台上进行测序。其中,WES在正常样本和肿瘤样本中的平均覆盖度分别达到268×和665×;WGS在正常样本和肿瘤样本中的平均覆盖度分别达到46×和49×。
数据分析
原始测序数据经SOAPnuke过滤后,高质量数据导入Sentieon分析流程。该流程严格遵循GATK最佳实践,基于UCSC人类参考基因组(hg19)高效完成比对与数据处理。
在胚系变异检测环节中,研究团队针对有PDAC家族史的患者,使用Sentieon Haplotyper 算法在WES数据中精准鉴定SNP和Indel,随后利用GATK模块完成变异过滤。

图1 Sentieon的作用
在体细胞变异检测环节中,利用WES和WGS数据检测体细胞层面的SNP和Indel。为确保结果的准确性,采用了多软件交叉验证的策略:SNV:整合Mutect2、Strelka2、Lancet、Muse 和SomaticSniper的检测结果;Indel:整合Strelka2、Lancet、Mutect2和Svaba的检测结果; 高可信变异:定义为至少被两个变异软件(或算法)共同检出的位点。
为排除潜在的胚系变异干扰,研究团队设定了严格的过滤标准:
(1)基于数据库与测序深度的过滤:
针对dbSNP收录的变异:若在配对正常样本中支持Reads数<19条,或者未被COSMIC数据库收录,则予以排除;
针对未收录于dbSNP的变异:若正常样本中的支持Reads数<8条,予以排除。
(2)基于人群频率的过滤:排除在千人基因组计划和ExAC数据库中次等位基因频率(MAF)>0.1% 的变异,但ClinVar注释为“致病性”的变异除外。
其他变异类型方面,研究使用FACETS鉴定WES和WGS数据中的拷贝数变异(CNV),并利用Manta检测WGS数据中的结构变异(SV)。
变异的临床意义分类
研究团队将检测到的SNV和Indel按临床意义划分为四类:
(1)临床显著性变异:在ClinVar数据库中被注释为“致病”或“可能致病”的变异;
(2)潜在临床显著性a:在ClinVar中被注释为“意义未明(VUS)”或未被收录的截断突变(包括无义突变、移码突变或涉及 ±1/2 剪接位点的突变);
(3)潜在临床显著性b:在ClinVar中被注释为VUS或未被收录,且经生信软件预测为有害的变异。具体标准为:
- 错义突变:经MetaSVM、MetalLR和FATHMM-MKL三种算法中任意一种预测为有害;
- Indel:经SIFT算法预测为有害。
(4)非临床显著性变异:在ClinVar中被注释为“良性”或“可能良性”的变异。
同源重组缺陷评分
研究采用scarHRD R包计算HRD评分。该算法基于基因组瘢痕特征,通过整合肿瘤倍性、纯度及等位基因特异性拷贝数图谱进行量化。此外,对于WGS数据,研究团队还额外引入了CHORD分类器进行辅助评估。
肿瘤突变负荷与新抗原预测
- TMB计算:TMB定义为编码区内非同义SNV和Indel的总数除以编码区的大小(以Mb为单位)。
- 新抗原预测:首先使用OptiType进行HLA等位基因分型。随后,基于结合亲和力筛选新抗原,筛选标准为:经至少一种算法预测结合亲和力<500nM。
- 新抗原负荷:最终估算为能与HLA-A等位基因结合的多肽数量。
研究结果
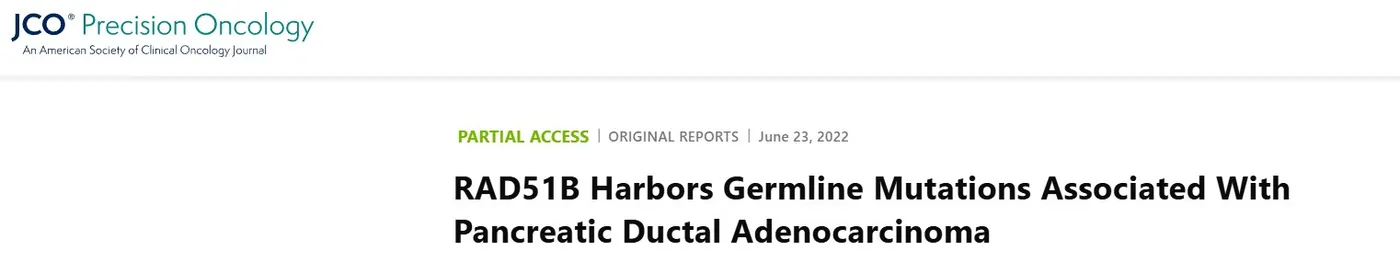
研究团队对8例有家族史的PDAC患者进行了详细的分析,患者平均年龄为67岁。共鉴定出12个HR-DDR基因变异,其中1 例患者携带3个变异,2例患者携带2个变异,其余5例各携带1个变异。基因变异中错义突变占大多数(9个);预测均会导致蛋白提前截断,从而引起BRCA2和RAD51B功能丧失的移码突变共2个;无义突变占1个。
值得注意的是,1例患者携带BRCA2的体细胞突变,其VAF仅为0.06。基因变异频率分析显示RAD51B突变频率最高(n=4,占50%),其次是BRIP1和RAD54L。RAD51B表现出的高频率胚系变异特征,强烈提示该基因可能在家族性PDAC的易感性中发挥着关键的作用。
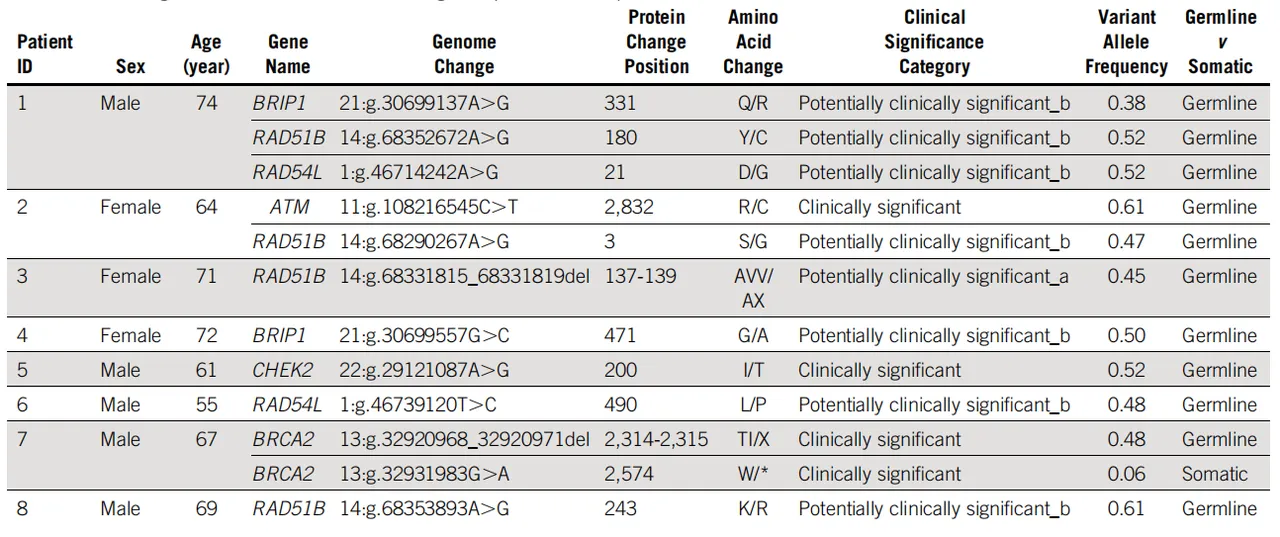
图2 胰腺导管腺癌中HR-DDR通路基因的变异统计
研究团队利用WGS数据对5例PDAC患者进行了结构变异评估。结果显示,携带3个HR-DDR基因变异的患者1检出的SV数量最高,其次是携带2个变异的患者2。这一趋势表明多重HR-DDR基因变异的叠加可能导致更显著的基因组不稳定性。
进一步分析发现,在患者1中鉴定出一个涉及RAD51B的染色体易位。该易位的断点位于RAD51B基因的内含子10,导致基因结构被破坏及蛋白截断,从而丧失了正常的DNA修复功能。
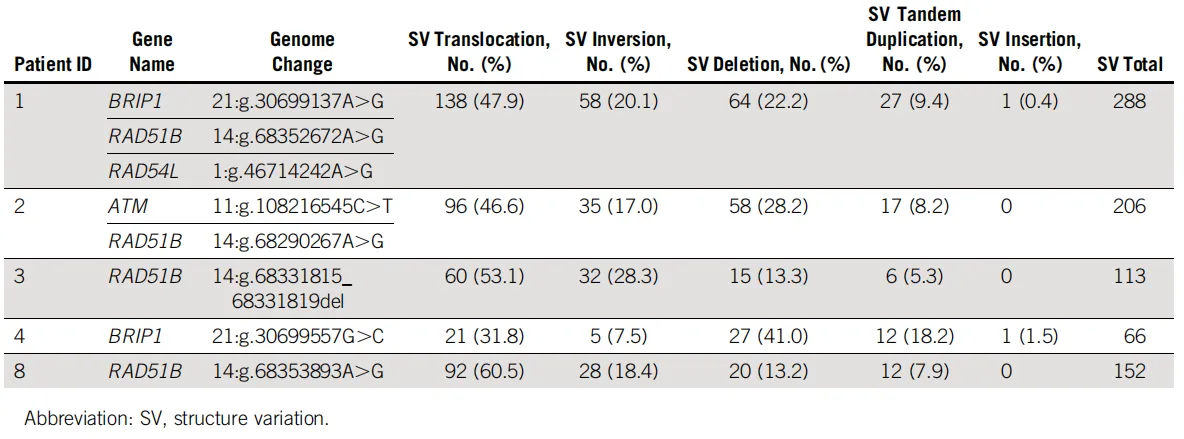
图3 携带HR-DDR基因变异的PDAC肿瘤中的结构变异(SV)统计
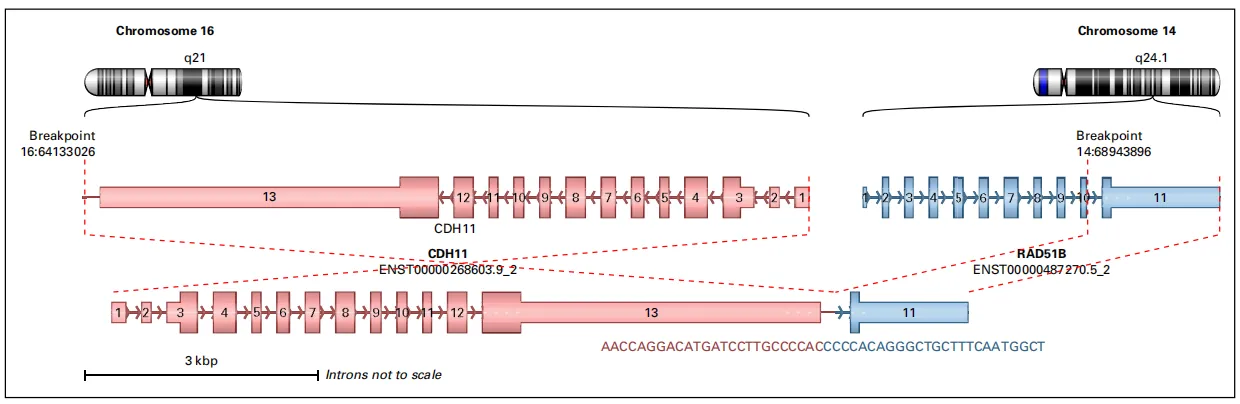
图4 基于WGS数据鉴定出的RAD51B易位结构变异;该图展示了易位发生的位置、融合伴侣、方向及断点连接片段。断点1:位于16号染色体(chr16:64133026),距CDH11基因844,631 bp。断点 2:位于14号染色体(chr14:68943896),坐落于RAD51B基因的内含子10中。 后果预测:该变异预计会导致RAD51B蛋白在第346位氨基酸(丙氨酸)处发生截断。 说明:14号和16号染色体上的断点连接片段分别以蓝色和粉色标记 。
在基于WES数据的情况下,检测出8例患者的HRD评分中位数为21.3。其中,携带2个临床显著性BRCA2变异的患者7评分最高,而携带1个临床显著性CHEK2变异的患者5评分最低。这一显著差异表明,并非所有HR-DDR基因变异都会导致同等的HRD状态。
在基于WGS数据的情况下,研究进一步对5例样本进行了scarHRD和CHORD算法评估。结果显示,scarHRD评分中位数为22,而CHORD评分中位数仅为0。携带 RAD51B变异的患者3获得了最高的scarHRD评分,进一步支持了RAD51B功能缺失会导致显著同源重组修复缺陷的观点。携带BRIP1变异的患者4虽然获得了最高的 CHORD评分,但整体队列的低评分提示,由CHORD算法定义的HRD表型在该 PDAC队列中并不普遍。
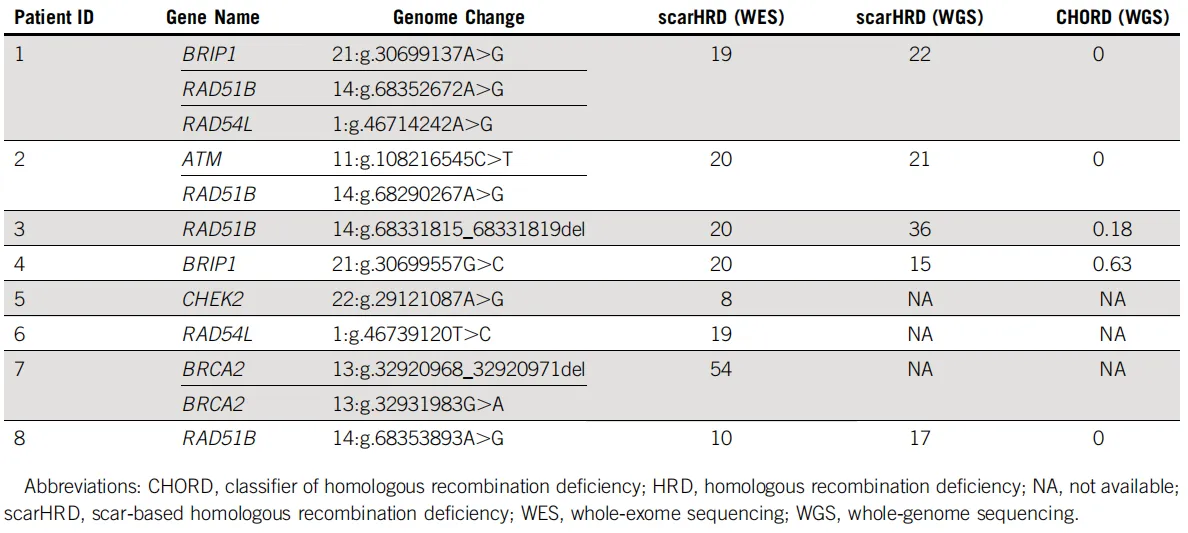
图5 HR-DDR基因变异对应的HRD评分及免疫特征
在免疫相关指标方面,研究团队评估了患者的新抗原负荷和肿瘤突变负荷(TMB),结果显示,整体队列的平均TMB为1.34。
研究发现携带RAD51B移码突变的患者3展现出最高的新抗原水平和TMB值。相反,携带CHEK2变异的患者5则未预测到新抗原,且TMB最低。这与其HRD评分为零的特征高度一致,提示该样本的基因组不稳定性最低。值得特别关注的是,4例携带RAD51B变异的肿瘤样本显示出相对较高的免疫原性,其平均新抗原负荷为62.3,平均TMB为1.75。
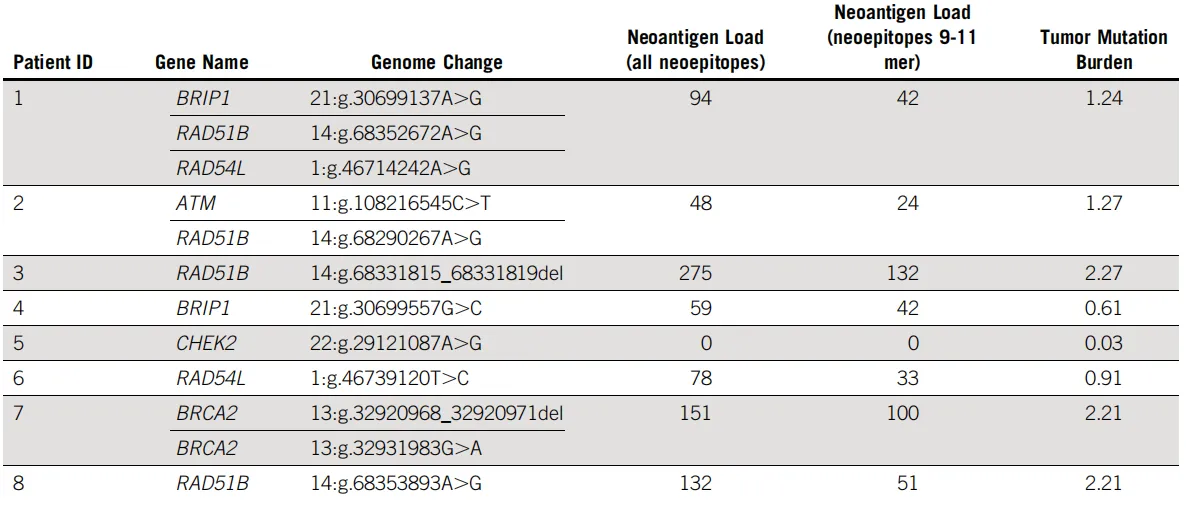
图6 携带HR-DDR基因变异的PDAC肿瘤的新抗原负荷与肿瘤突变负荷(TMB)
研究讨论
基因-表型相关性
综合分析显示,BRCA2突变与高HRD评分呈显著正相关,而CHEK2突变则与零HRD评分相关。不同的HR-DDR基因突变对应的HRD评分存在差异,这提示不同基因突变携带者对PARP抑制剂的治疗敏感性可能存在异质性。
免疫特征
研究发现,HR-DDR 缺陷型PDAC的TMB和新抗原负荷显著低于高TMB或微卫星高度不稳定的肿瘤。这一特征表明,HR-DDR缺陷本身并不会导致错义突变率的显著升高,因此推测此类患者对单药免疫检查点抑制剂(ICI)的治疗响应可能不佳。
RAD51B的重要发现
在8例携带HR-DDR 变异的患者中,有4例携带RAD51B变异,且均为胚系突变。作为RAD51蛋白家族的重要成员,RAD51B在DNA同源重组修复中发挥关键作用。鉴于目前常规的胚系基因检测Panel尚未覆盖RAD51B,该研究的发现支持将其纳入HR-DDR通路的胚系检测范围内。
研究局限性
研究受限于较小的样本量且为描述性研究的性质,结果的适用性会受到一定影响。未来需开展更大规模的研究队列,以进一步验证上述发现。
研究总结
该研究发现RAD51B在PDAC中具有较高的胚系突变频率,但在当前的临床遗传学检测Panel中往往未被涵盖。因此,研究结果强烈支持将其纳入HR-DDR通路基因的胚系检测Panel中,从而识别出更多可能从靶向治疗中获益的PDAC患者。


